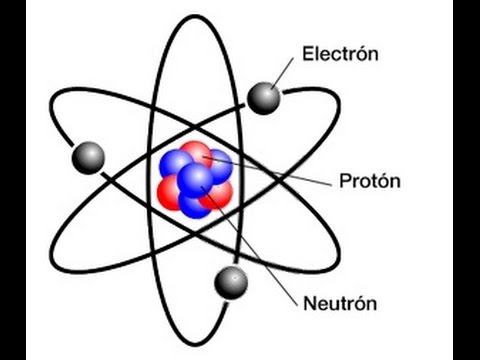
PROPIEDADES
Los elementos del grupo de los halógenos como el yodo se presentan como moléculas diatómicas químicamente activas. El nombre halógeno, proviene del griego y su significado es "formador de sales". Son elementos halógenos entre los que se encuentra el yodo, son oxidantes. Muchos compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales, contienen elementos halógenos como el yodo. A este tipo de compuestos se los conoce como compuestos halogenados.
El estado del yodo en su forma natural es sólido. El yodo es un elmento químico de aspecto violeta (Gas) Gris violáceo (Sólido) y pertenece al grupo de los halógenos. El número atómico del yodo es 53. El símbolo químico del yodo es I. El punto de fusión del yodo es de 355,95 grados Kelvin o de 83,8 grados celsius o grados centígrados. El punto de ebullición del yodo es de 457,4 grados Kelvin o de 185,25 grados celsius o grados centígrados.
El yodo es un mineral que nuestro organismo necesita para su correcto funcionamiento y se puede encontrar en los alimentos. A través del siguiente enlace, podrás encontrar una lista de alimentos con yodo.
PROPIEDADES ATÓMICAS
La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el yodo dentro de la tabla periódica de los elementos, el yodo se encuentra en el grupo 17 y periodo 5. El yodo tiene una masa atómica de 126,90447 u.
La configuración electrónica del yodo es [Kr]4d105s25p5. La configuración electrónica de los elementos, determina la forma el la cual los electrones están estructurados en los átomos de un elemento. El radio medio del yodo es de 140 pm, su radio atómico o radio de Bohr es de 115 pm, su radio covalente es de 133 pm y su radio de Van der Waals es de 198 pm. El yodo tiene un total de 53 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones, en la cuarta, 18 electrones y en la quinta capa tiene 7 electrones.
CARACTERÍSTICAS DEL YODO
A continuación puedes ver una tabla donde se muestra las principales características que tiene el yodo.
| Yodo | ||
|---|---|---|
| Símbolo químico | I | |
| Número atómico | 53 | |
| Grupo | 17 | |
| Periodo | 5 | |
| Aspecto | violeta (Gas) Gris violáceo (Sólido) | |
| Bloque | p | |
| Densidad | 4.940 kg/m3 | |
| Masa atómica | 126.90447 u | |
| Radio medio | 140 pm | |
| Radio atómico | 115 | |
| Radio covalente | 133 pm | |
| Radio de van der Waals | 198 pm | |
| Configuración electrónica | [Kr]4d105s25p5 | |
| Electrones por capa | 2, 8, 18, 18, 7 | |
| Estados de oxidación | -1, 1, 3, 5, 7 | |
| Óxido | ácido fuerte | |
| Estructura cristalina | ortorrómbica | |
| Estado | sólido | |
| Punto de fusión | 355.95 K | |
| Punto de ebullición | 457.4 K | |
| Calor de fusión | 7.824 kJ/mol | |
| Electronegatividad | 2,66 | |
| Calor específico | 145 J/(K·kg) | |
| Conductividad eléctrica | 8,0 × 10-8S/m | |
| Conductividad térmica | 0,9W/(k·m) | |


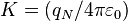 , siendo
, siendo 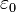 la
la  la carga eléctrica del centro dispersor.
la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente.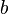 es el parámetro de impacto.
es el parámetro de impacto.