Creo que es una nueva y buena forma de trabajar,en ocasiones más entretenida y en ocasiones más pesada en el sentido de buscar imágenes,subirlas de tu propio ordenador...
En general me ha gustado ver como se pueden haces bastantes cosas por aquí y poder usar esta herramienta como cuaderno de clase.
He aprendido bastante sobre los ordenadores y programas para trabajar,hacer presentaciones...
Ha sido un año bastante bueno y e que como ya dije antes he aprendido mucho.Un saludo
viernes, 10 de junio de 2016
GRUPO VERDE
En esta entrada os voy a mostrar el trabajo sobre física realizado con algunos de mis compañeros.
Aquí os la presento,espero que os guste y que aprendais un poco de física básica.
OPINIÓN PERSONAL DEL TRABAJO REALIZADO POR EL GRUPO VERDE
Durante la realización de este trabajo ha habido algunos contratiempos con ciertas personas del grupo que han trabajado mucho menos que otras,pero bueno lo que me llevo de este trabajo no es eso si no las cosas aprendidas gracias a él;conceptos básicos de física como:acelarión,espacio recorrido,velocidad,gravedad...todo esto que ahora nos parece tan simple, en tiempos anteriores cuando fueron descubiertos por grandes científicos era marca de un gran avance y cultura.
Aquí os la presento,espero que os guste y que aprendais un poco de física básica.
OPINIÓN PERSONAL DEL TRABAJO REALIZADO POR EL GRUPO VERDE
Durante la realización de este trabajo ha habido algunos contratiempos con ciertas personas del grupo que han trabajado mucho menos que otras,pero bueno lo que me llevo de este trabajo no es eso si no las cosas aprendidas gracias a él;conceptos básicos de física como:acelarión,espacio recorrido,velocidad,gravedad...todo esto que ahora nos parece tan simple, en tiempos anteriores cuando fueron descubiertos por grandes científicos era marca de un gran avance y cultura.
CASEÍNA
En esta reacción química lo que ha pasado es lo siguiente:
Al mezclar ambas sustancias, el ácido ortofosfórico de la Coca-Cola reacciona y proporciona una mayor densidad a la leche. Esto es lo que hace que ambas sustancias se separen y se hundan hacia abajo, mientras que el liquido restante se queda en la superficie. La parte sólida no es más que la leche, que se ha cuajado al mezclarse con la Coca-Cola,así se forma la caseína.
Mi propio experimento no me salió muy bien....lo que ocurrió fue que al filtrar los polvos de caseína que aparecen en el vaso de la mezcla se rompió el filtro,por lo cual el experimento fracasó.
Al mezclar ambas sustancias, el ácido ortofosfórico de la Coca-Cola reacciona y proporciona una mayor densidad a la leche. Esto es lo que hace que ambas sustancias se separen y se hundan hacia abajo, mientras que el liquido restante se queda en la superficie. La parte sólida no es más que la leche, que se ha cuajado al mezclarse con la Coca-Cola,así se forma la caseína.
Mi propio experimento no me salió muy bien....lo que ocurrió fue que al filtrar los polvos de caseína que aparecen en el vaso de la mezcla se rompió el filtro,por lo cual el experimento fracasó.
jueves, 19 de mayo de 2016
BAÑO DE COBRE
En esta entrada vamos a ver como un clavo se baña en cobre,para conseguir esto debemos seguir los siguientes pasos:
Al introducir el clavo de hierro en el líquido que contiene iones positivos se produce una reacción de oxidación reducción .El hierro de oxida,pierde electrones y el cobre se reduce,gana electrones y pasa de iones positivos a cobre metálico que se deposita sobre el clavo.
- Introducir en un vaso tres cucharadas o así de sal
- Añadir unas monedas de cobre (1 céntimo,2 céntimos,5 céntimos)
- A continuación introducir vinagre hasta cubrir las monedas
- Agitar el vaso durante unos dos minutos sin que se salga lo que antes introducimos
- Esperamos media hora
- Después de esperar media hora debemos introducir el clavo
- Una vez introducido esperamos unas dos horas aproximadamente y ya estará con el color del cobre
- Si esperas más tiempo pues más bañado en cobre estará.
Al introducir el clavo de hierro en el líquido que contiene iones positivos se produce una reacción de oxidación reducción .El hierro de oxida,pierde electrones y el cobre se reduce,gana electrones y pasa de iones positivos a cobre metálico que se deposita sobre el clavo.
martes, 3 de mayo de 2016
EXPERIMENTO CASERO
En esta nueva entrada os voy a mostrar un ejemplo de una reacción química,para ello hay unos pasos a seguir:
Este es el resultado


para llegar a esto,como veis se necesita un globo,una botella,cáscara de huevo y vinagre
La cáscara de huevo principalmente está compuesta por carbonato de calcio,por otro lado,el vinagre es un ácido acético.Cuando juntamos un carbonato con un ácido tiene lugar una reacción química en la que se neutraliza el ácido y en la que se obtienen productos como una sal,agua y dióxido de carbono.
Ácido acético (vinagre)+ carbonato de calcio + agua + dióxido de carbono.
Las burbujas que se desprenden de las cáscaras de huevo son dióxido de carbono,que irá en aumento según se vaya produciendo la reacción.De esta manera pasados unos minutos el gas CO2 habrá conseguido inflar el globo.
Este es el resultado


para llegar a esto,como veis se necesita un globo,una botella,cáscara de huevo y vinagre
- primeramente se echa la cáscara de huevo en la botella
- a continuación se añade vinagre hasta cubrir las cáscaras
- finalmente se coloca el globo en la boquilla de la botella y esperamos a que se produzca la reacción
La cáscara de huevo principalmente está compuesta por carbonato de calcio,por otro lado,el vinagre es un ácido acético.Cuando juntamos un carbonato con un ácido tiene lugar una reacción química en la que se neutraliza el ácido y en la que se obtienen productos como una sal,agua y dióxido de carbono.
Ácido acético (vinagre)+ carbonato de calcio + agua + dióxido de carbono.
Las burbujas que se desprenden de las cáscaras de huevo son dióxido de carbono,que irá en aumento según se vaya produciendo la reacción.De esta manera pasados unos minutos el gas CO2 habrá conseguido inflar el globo.
lunes, 18 de abril de 2016
COMPUESTOS BINARIOS
martes, 22 de marzo de 2016
LOA CONDUCTOS DE LA INDUSTRIA
Los conductos de la industria

En este vídeo se ve el cambio de actitud de las industrias respecto al gasto de agua centrándose en aquellas que necesitan una cantidad enorme de agua para la producción:papel,acero,cerveza.
El agua utilizada en la industria del acero es devuelta al medio ambiente cargada de sustancias químicas,en la actualidad se esta cimentando una nueva forma de pensar y producir.Una empresa japonesa de acero encabeza la lista de las industrias preocupadas por la política medioambiental y de conservación del agua.En Egipto todavía se produce el papiro,la más antigua forma de papel.En Canadá una fabrica se convirtió en la primera planta de pulpa de papel sin emisiones tóxicas del mundo.

LA BÚSQUEDA INTERMINABLE
La búsqueda interminable de agua
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-busqueda-interminable/1972848/
Este vídeo trata de la búsqueda de agua limpia,un recurso básico para la supervivencia y el desarrollo,esta búsqueda ha sido un reto fundamentalmente para las personas que viven en zonas áridas.Se ve como se resuelven los problemas de escasez de agua desde el desierto de Kalahari,donde los nativos muestran su ingenio,a los habitantes de México donde el agua de los acuíferos se esta desecando para abastecer a una población cada vez más creciente.
En el interior de Australia una familia de ganaderos utiliza el conocimiento de los aborígenes para buscar en el paisaje pistas que lees ayuden a recoger y almacenar el agua de la lluvia.
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-busqueda-interminable/1972848/
Este vídeo trata de la búsqueda de agua limpia,un recurso básico para la supervivencia y el desarrollo,esta búsqueda ha sido un reto fundamentalmente para las personas que viven en zonas áridas.Se ve como se resuelven los problemas de escasez de agua desde el desierto de Kalahari,donde los nativos muestran su ingenio,a los habitantes de México donde el agua de los acuíferos se esta desecando para abastecer a una población cada vez más creciente.
En el interior de Australia una familia de ganaderos utiliza el conocimiento de los aborígenes para buscar en el paisaje pistas que lees ayuden a recoger y almacenar el agua de la lluvia.
domingo, 20 de marzo de 2016
AGUA,GUERRA Y PAZ
Agua,guerra y paz
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-agua-guerra-paz/2025922/
En este vídeo se ve la importancia que tiene el agua en las crisis mundiales,unas veces en forma de conflictos y otras veces como negociaciones de paz.Se toma como ejemplo el tribunal de las aguas de de Valencia donde los agricultores solucionan sus disputas sobre el agua a nivel local.Turquía esta construyendo una seria de presas para un grandioso plan hidroeléctrico en los ríos Eúfrates y Tigris conocido como proyecto de Gap,que supone beneficio para Turquía.
En la cuenca del río Jordan las relaciones entre países ha estado marcada por conflictos militares por el agua.
Pienso que se deberían de hacer más tribunales de las aguas en el resto del mundo para que también resuelvan sus problemas como lo hacen los valencianos.
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-agua-guerra-paz/2025922/
En este vídeo se ve la importancia que tiene el agua en las crisis mundiales,unas veces en forma de conflictos y otras veces como negociaciones de paz.Se toma como ejemplo el tribunal de las aguas de de Valencia donde los agricultores solucionan sus disputas sobre el agua a nivel local.Turquía esta construyendo una seria de presas para un grandioso plan hidroeléctrico en los ríos Eúfrates y Tigris conocido como proyecto de Gap,que supone beneficio para Turquía.
En la cuenca del río Jordan las relaciones entre países ha estado marcada por conflictos militares por el agua.
Pienso que se deberían de hacer más tribunales de las aguas en el resto del mundo para que también resuelvan sus problemas como lo hacen los valencianos.
Guerra del agua (Bolivia)
La guerra del Agua es el nombre popular de una serie de protestas que tuvieron lugar en Cochabamba, la tercera ciudad más poblada de Bolivia, entre los meses de enero y abril de 2000. Su detonante fue la privatización del abastecimiento deagua potable municipal.
En septiembre de 1999, impulsada por el Banco Mundial, la multinacional Bechtel firmó un contrato con Hugo Banzer, presidente y antiguo dictador de Bolivia, para privatizar el servicio de suministro de agua a Cochabamba. El contrato fue oficialmente adjudicado a una empresa denominada Aguas del Tunari, un consorcio empresarial formado por Bechtel (que participaba con el 27,5 por ciento), la empresa norteamericana Edison, las empresas bolivianas A. Petricevich y S. Doria Medina, así como el consorcio español Abengoa S.A. (que participaba con el 25 por ciento).
sábado, 19 de marzo de 2016
DESAFIO DEL TRANSPORTE DEL AGUA
Desafió del transporte del agua
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-gota-vida-desafio-del-transporte/2018858/
En los países desarrollados, la gente no se plantea lo que implica el poder abrir un grifo de agua y que salga agua.Sin embargo,para mantenerla son necesarias grandes inversiones e infraestructuras.
En el vídeo nos cuenta como en el pueblo de los Masais se encargan de transportar el agua los niños y las mujeres,un poco de agua para ellos es un gran regalo.Recorren grandes distancias con una jarra en la cabeza.
El transporte de agua siempre ha sido un reto para los humanos aunque antiguamente los romanos inventaron los acueductos por donde se transportaba el agua de forma natural.
Yo pienso que a muchas personas habría que enseñarles este vídeo ya que gastan cantidades de agua sin pensar en lo que cuesta el transporte hacía sus casas.
ACTUALMENTE

ANTIGUAMENTE Y ACTUALMENTE EN PAÍSES NO DESARROLLADOS
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-gota-vida-desafio-del-transporte/2018858/
En los países desarrollados, la gente no se plantea lo que implica el poder abrir un grifo de agua y que salga agua.Sin embargo,para mantenerla son necesarias grandes inversiones e infraestructuras.
En el vídeo nos cuenta como en el pueblo de los Masais se encargan de transportar el agua los niños y las mujeres,un poco de agua para ellos es un gran regalo.Recorren grandes distancias con una jarra en la cabeza.
El transporte de agua siempre ha sido un reto para los humanos aunque antiguamente los romanos inventaron los acueductos por donde se transportaba el agua de forma natural.
Yo pienso que a muchas personas habría que enseñarles este vídeo ya que gastan cantidades de agua sin pensar en lo que cuesta el transporte hacía sus casas.
ACTUALMENTE

ANTIGUAMENTE Y ACTUALMENTE EN PAÍSES NO DESARROLLADOS
EL CURSO DEL RÍO
El curso del río
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-curso-del-rio/2009036/
Este vídeo trata sobre el daño que hace el hombre al desviar el curso del río para su beneficio en vez de mirar más a la naturaleza que es lo que principalmente se debe tener en cuenta
Antiguamente las personas se adaptaban al curso del río porque no tenían agua en sus casas así que yo pienso que si ellos vivían,nosotros que tenemos muchos más recursos también.
En Retalhuleu, los residentes se quejan del bajo caudal de los afluentes y la contaminación.
http://www.rtve.es/alacarta/videos/agua-la-gota-de-la-vida/agua-curso-del-rio/2009036/
Este vídeo trata sobre el daño que hace el hombre al desviar el curso del río para su beneficio en vez de mirar más a la naturaleza que es lo que principalmente se debe tener en cuenta
Antiguamente las personas se adaptaban al curso del río porque no tenían agua en sus casas así que yo pienso que si ellos vivían,nosotros que tenemos muchos más recursos también.
En Retalhuleu, los residentes se quejan del bajo caudal de los afluentes y la contaminación.
Este afluente recorre 12 municipios de Santa Rosa, y en toda la cuenca hay cambios de cauce intencional, entre los que se incluye también el que hace la hidroeléctrica Los Esclavos.
Pobladores señalaron que estas empresas, además desviar el caudal, lanzan las aguas residuales y desechos sólidos al río y eso genera otro problema, la contaminación.
Jaime Marroquín, vecino de Chiquimulilla, señaló que es triste lo que sucede, pues los agricultores y residentes se ven afectados por la falta de agua en el río.
Lamentó que ninguna autoridad vele por la conservación del agua. Refirió que por el desvío, varias comunidades no tienen agua y si hay un poco, no se puede consumir porque está contaminada.
domingo, 13 de marzo de 2016
ENLACES QUÍMICOS
https://bubbl.us/mindmap
Lo pongo así porque no soy capaz de subirlo en modo foto
Ejemplo de enlace iónico

Ejemplo de enlace covalente

Ejemplo de enlace metálico

Lo pongo así porque no soy capaz de subirlo en modo foto
Ejemplo de enlace iónico
Ejemplo de enlace covalente
Ejemplo de enlace metálico
lunes, 29 de febrero de 2016
QUARK
En física de partículas, los cuarks o quarks, junto con los leptones, son los constituyentes fundamentales de la materia. Varias especies de quarks se combinan de manera específica para formar partículas subatómicastales como protones y neutrones.
En la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados hadrones, de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento del color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los pentaquark , cuya evidencia, en principio controvertida , fue demostrada gracias alGran Colisionador de Hadrones en julio de 2015.
DESCUCBRIMIENTO
A mediados de la década de 1960 había un cierto consenso en que el protón poseía un tamaño aproximado de 10–15 m con una distribución suave de carga en su interior. Los análisis de ciertas propiedades de reacciones de altas energías de hadrones llevó a Richard Feynman a postular subestructuras de hadrones, a los que él llamo partones (porque eran parte de los hadrones).

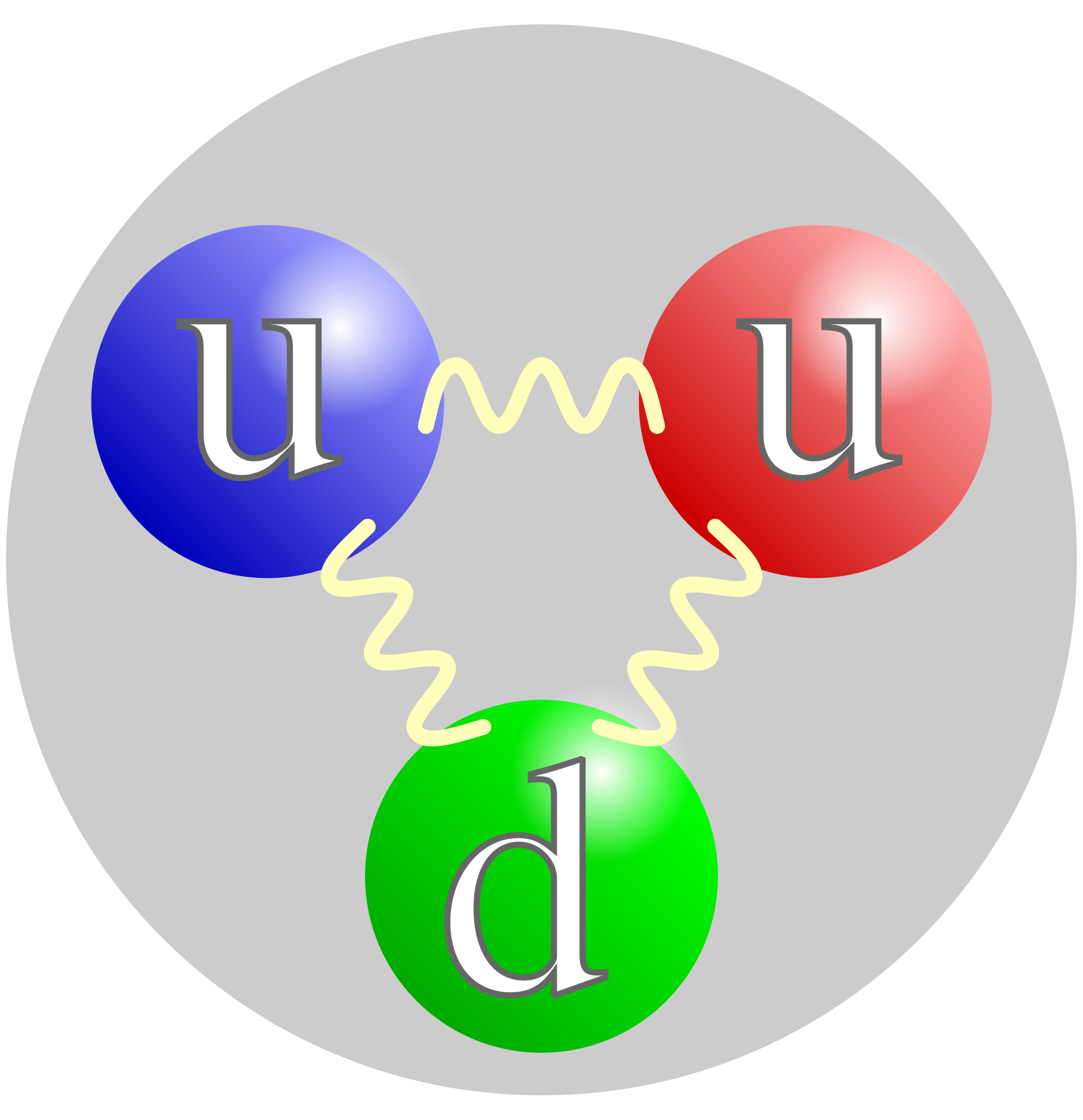
Bastante me raya este tema sabiendo que estamos hechos de neutrones,protones y electrones,asi que sabiendo que existen patículas aún más pequeñas pues me rayo más aún,pero bueno es la verdad por mucho que queramos quejarnos
En la naturaleza no se encuentran quarks aislados. Estos siempre se encuentran en grupos, llamados hadrones, de dos o tres quarks, conocidos como mesones y bariones respectivamente. Esto es una consecuencia directa del confinamiento del color. En el año 2003 se encontró evidencia experimental de una nueva asociación de cinco quarks, los pentaquark , cuya evidencia, en principio controvertida , fue demostrada gracias alGran Colisionador de Hadrones en julio de 2015.
DESCUCBRIMIENTO
A mediados de la década de 1960 había un cierto consenso en que el protón poseía un tamaño aproximado de 10–15 m con una distribución suave de carga en su interior. Los análisis de ciertas propiedades de reacciones de altas energías de hadrones llevó a Richard Feynman a postular subestructuras de hadrones, a los que él llamo partones (porque eran parte de los hadrones).


Bastante me raya este tema sabiendo que estamos hechos de neutrones,protones y electrones,asi que sabiendo que existen patículas aún más pequeñas pues me rayo más aún,pero bueno es la verdad por mucho que queramos quejarnos
lunes, 22 de febrero de 2016
CRUCIGRAMA
Lo he hecho a traves de una herramienta que nos dijo nuestro profesor,he cogido algunas características,símbolos,utilidades de dichos materiales y lo he hecho
TABLA PERIÓDICA
He elegido una página de google en la que viene la tabla periódica y de que palabras proceden los nombres de los símbolos y para que sirven cada uno de ellos https://sites.google.com/site/389tablaperiodica/simbolo
Hace unas dos semanas fuimos de excursión a Lisboa y paseando por allí nos encontramos una gran tabla periódica,no solo venían los símbolos,nombres y átomos si no que al lado había una pequeña pantalla en la que te explica las propiedades de cada elemento.
Mi compañera ha hecho muy buen trabajo y además ha subido una foto que nos hicimos con la última tabla nombrada http://descubriendofisicayquim.blogspot.com.es/
Hace unas dos semanas fuimos de excursión a Lisboa y paseando por allí nos encontramos una gran tabla periódica,no solo venían los símbolos,nombres y átomos si no que al lado había una pequeña pantalla en la que te explica las propiedades de cada elemento.
Mi compañera ha hecho muy buen trabajo y además ha subido una foto que nos hicimos con la última tabla nombrada http://descubriendofisicayquim.blogspot.com.es/
domingo, 31 de enero de 2016
YODO
Este es el segundo elemento químico sobre el que os voy a hablar.(via http://elementos.org.es/yodo)
PROPIEDADES
Los elementos del grupo de los halógenos como el yodo se presentan como moléculas diatómicas químicamente activas. El nombre halógeno, proviene del griego y su significado es "formador de sales". Son elementos halógenos entre los que se encuentra el yodo, son oxidantes. Muchos compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales, contienen elementos halógenos como el yodo. A este tipo de compuestos se los conoce como compuestos halogenados.
PROPIEDADES
Los elementos del grupo de los halógenos como el yodo se presentan como moléculas diatómicas químicamente activas. El nombre halógeno, proviene del griego y su significado es "formador de sales". Son elementos halógenos entre los que se encuentra el yodo, son oxidantes. Muchos compuestos sintéticos orgánicos y algunos compuestos orgánicos naturales, contienen elementos halógenos como el yodo. A este tipo de compuestos se los conoce como compuestos halogenados.
El estado del yodo en su forma natural es sólido. El yodo es un elmento químico de aspecto violeta (Gas) Gris violáceo (Sólido) y pertenece al grupo de los halógenos. El número atómico del yodo es 53. El símbolo químico del yodo es I. El punto de fusión del yodo es de 355,95 grados Kelvin o de 83,8 grados celsius o grados centígrados. El punto de ebullición del yodo es de 457,4 grados Kelvin o de 185,25 grados celsius o grados centígrados.
El yodo es un mineral que nuestro organismo necesita para su correcto funcionamiento y se puede encontrar en los alimentos. A través del siguiente enlace, podrás encontrar una lista de alimentos con yodo.
PROPIEDADES ATÓMICAS
La masa atómica de un elemento está determinado por la masa total de neutrones y protones que se puede encontrar en un solo átomo perteneciente a este elemento. En cuanto a la posición donde encontrar el yodo dentro de la tabla periódica de los elementos, el yodo se encuentra en el grupo 17 y periodo 5. El yodo tiene una masa atómica de 126,90447 u.
La configuración electrónica del yodo es [Kr]4d105s25p5. La configuración electrónica de los elementos, determina la forma el la cual los electrones están estructurados en los átomos de un elemento. El radio medio del yodo es de 140 pm, su radio atómico o radio de Bohr es de 115 pm, su radio covalente es de 133 pm y su radio de Van der Waals es de 198 pm. El yodo tiene un total de 53 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones, en la cuarta, 18 electrones y en la quinta capa tiene 7 electrones.
CARACTERÍSTICAS DEL YODO
A continuación puedes ver una tabla donde se muestra las principales características que tiene el yodo.
| Yodo | ||
|---|---|---|
| Símbolo químico | I | |
| Número atómico | 53 | |
| Grupo | 17 | |
| Periodo | 5 | |
| Aspecto | violeta (Gas) Gris violáceo (Sólido) | |
| Bloque | p | |
| Densidad | 4.940 kg/m3 | |
| Masa atómica | 126.90447 u | |
| Radio medio | 140 pm | |
| Radio atómico | 115 | |
| Radio covalente | 133 pm | |
| Radio de van der Waals | 198 pm | |
| Configuración electrónica | [Kr]4d105s25p5 | |
| Electrones por capa | 2, 8, 18, 18, 7 | |
| Estados de oxidación | -1, 1, 3, 5, 7 | |
| Óxido | ácido fuerte | |
| Estructura cristalina | ortorrómbica | |
| Estado | sólido | |
| Punto de fusión | 355.95 K | |
| Punto de ebullición | 457.4 K | |
| Calor de fusión | 7.824 kJ/mol | |
| Electronegatividad | 2,66 | |
| Calor específico | 145 J/(K·kg) | |
| Conductividad eléctrica | 8,0 × 10-8S/m | |
| Conductividad térmica | 0,9W/(k·m) | |
sábado, 30 de enero de 2016
ZINC
En esta entrada os voy a hablar sobre el elemento químico zinc.
PROPIEDADES

PROPIEDADES
Los metales de transición, también llamados elementos de transición es el grupo al que pertenece el zinc. En este grupo de elementos químicos al que pertenece el zinc, se encuentran aquellos situados en la parte central de la tabla periódica, concretamente en el bloque d. Entre las características que tiene el zinc, así como las del resto de metales de tansición se encuentra la de incluir en su configuración electrónica el orbital d, parcialmente lleno de electrones. Propiedades de este tipo de metales, entre los que se encuentra el zinc son su elevada dureza, el tener puntos de ebullición y fusión elevados y ser buenos conductores de la electricidad y el calor.
El estado del zinc en su forma natural es sólido (diamagnético). El zinc es un elmento químico de aspecto azul pálido grisáceo y pertenece al grupo de los metales de transición. El número atómico del zinc es 30. El símbolo químico del zinc es Zn. El punto de fusión del zinc es de 692,68 grados Kelvin o de 420,53 grados celsius o grados centígrados. El punto de ebullición del zinc es de 1180 grados Kelvin o de 907,85 grados celsius o grados centígrados.
El zinc es un mineral que nuestro organismo necesita para su correcto funcionamiento y se puede encontrar en los alimentos. A través del siguiente enlace, podrás encontrar una lista de alimentos con zinc.
USOS
El zinc es un metal de color entre blanco azulado y gris plateado. Es duro y frágil a la mayoría de temperaturas, pero se puede hacer maleable por calentamiento a entre 100 y 150 grados Celsius. Se encuentra normalmente con otros metales comunes, tales como el cobre y el plomo. Los mayores yacimientos de zinc se encuentran en Australia, Asia y los Estados Unidos. El zinc es un mineral esencial y es importante para muchos aspectos de la salud humana. Si alguna vez te has preguntado para qué sirve el zinc, a continuación tienes una lista de sus posibles usos:
- El zinc se utiliza principalmente como un agente anti-corrosiva en productos de metal. Se utiliza en el proceso de galvanización. La galvanización es el recubrimiento de otros metales con hierro o acero. Aproximadamente la mitad del zinc que se usa en el mundo es para galvanización. La galvanización se utiliza para fabricar tela metálica, barandillas, puentes colgantes, postes de luz, techos de metal, intercambiadores de calor y carrocerías de coches.
- El zinc se usa como un ánodo en otros metales, en particular los metales que se utilizan en trabajos eléctricos o que entran en contacto con agua de mar.
- También se utiliza para el ánodo en las baterías. En pilas de zinc y carbono se utiliza una lámina de este metal.
- El zinc es aleado con cobre para crear latón. El latón se utiliza una amplia variedad de productos tales como tuberías, instrumentos, equipos de comunicaciones, herramientas y válvulas de agua.
- También se utiliza en aleaciones con elementos como el niquel, el aluminio (para soldar) y el bronce.
- En algunos países, tales como los Estados Unidos, el zinc se utiliza para fabricar monedas.
- El zinc se utiliza con el cobre, el magnesio y el aluminio en las industrias del automóvil, eléctrica y para hacer herramientas.
- El óxido de zinc se utiliza como un pigmento blanco en pinturas y tintas de fotocopiadoras.
- El óxido de zinc se utiliza también en el caucho para protegerlo de la radiación UV.
- El cloruro de zinc se utiliza en la madera como retardante del fuego y para conservarla.
- El sulfuro de zinc se utiliza como pintura luminiscente de las superficies de los relojes, rayos X, pantallas de televisión y pinturas que brillan en la oscuridad.
- También se utiliza en fungicidas agrícolas.
- El zinc también se utiliza en los suplementos dietéticos. Es de gran ayuda en la curación de heridas, la reducción de la duración y severidad de los resfriados y tiene propiedades antimicrobianas que ayudan a aliviar los síntomas de la gastroenteritis.
- También se utiliza en protectores solares. Se utiliza en los dentífricos para evitar el mal aliento y en champús para detener la caspa.
CARACTERÍSTICASA continuación puedes ver una tabla donde se muestra las principales características que tiene el zinc.
| Zinc | ||
|---|---|---|
| Símbolo químico | Zn | |
| Número atómico | 30 | |
| Grupo | 12 | |
| Periodo | 4 | |
| Aspecto | azul pálido grisáceo | |
| Bloque | d | |
| Densidad | 7140 kg/m3 | |
| Masa atómica | 65.409 u | |
| Radio medio | 135 pm | |
| Radio atómico | 142 | |
| Radio covalente | 131 pm | |
| Radio de van der Waals | 139 pm | |
| Configuración electrónica | [Ar]3d104s2 | |
| Electrones por capa | 2, 8, 18, 2 | |
| Estados de oxidación | 2 | |
| Óxido | anfótero | |
| Estructura cristalina | hexagonal | |
| Estado | sólido | |
| Punto de fusión | 692.68 K | |
| Punto de ebullición | 1180 K | |
| Calor de fusión | 7.322 kJ/mol | |
| Presión de vapor | 192,2 Pa a 692,73 K | |
| Electronegatividad | 1,6 | |
| Calor específico | 390 J/(K·kg) | |
| Conductividad eléctrica | 16,6·106S/m | |
| Conductividad térmica | 116 W/(K·m) | |
Suscribirse a:
Entradas (Atom)







